LOS ÁNGELES, 22 ago (Xinhua) –La Administración de Alimentos y Medicamentos de Estados Unidos, (FDA, por sus siglas en inglés) aprobó y concedió hoy la autorización para el uso de emergencia de las vacunas de ARNm contra la COVID-19 con el fin de lograr una mejor protección contra las variantes actualmente en circulación. La FDA dijo que las variantes actualizadas actuarán contra la cepa KP.2 de la variante Ómicron. “Dada la decreciente inmunidad de la población derivada de una exposición previa al virus y de la vacunación previa, exhortamos con firmeza a quienes sean elegibles a considerar aplicarse una vacuna actualizada contra la COVID-19 con el fin de lograr una mejor protección contra las variantes actualmente en circulación”, dijo Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA. “Las vacunas de ARNm contra la COVID-19 son Comirnaty y Spikevax, ambas aprobadas para individuos de 12 años en adelante, y las vacunas anticovid de Moderna y de Pfizer-BioNTech, las cuales están autorizadas para su uso de emergencia en individuos de entre 6 meses y 11 años de edad”, agregó la FDA en un boletín de prensa. Fin
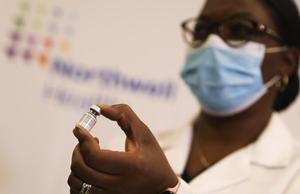 (201214) -- NUEVA YORK, 14 diciembre, 2020 (Xinhua) -- Una trabajadora de la salud muestra un frasco de la vacuna contra la COVID-19 en el Centro Médico Judío de Long Island, en Nueva York, Estados Unidos, el 14 de diciembre de 2020. Estados Unidos inició el lunes el despliegue de la primera vacuna contra la COVID-19 y las primeras dosis fueron administradas a los trabajadores de la salud y al personal de asilos. (Xinhua/Wang Ying) (ah) (ra) (vf)
(201214) -- NUEVA YORK, 14 diciembre, 2020 (Xinhua) -- Una trabajadora de la salud muestra un frasco de la vacuna contra la COVID-19 en el Centro Médico Judío de Long Island, en Nueva York, Estados Unidos, el 14 de diciembre de 2020. Estados Unidos inició el lunes el despliegue de la primera vacuna contra la COVID-19 y las primeras dosis fueron administradas a los trabajadores de la salud y al personal de asilos. (Xinhua/Wang Ying) (ah) (ra) (vf) 